La Agencia Europea de Medicamentos (EMA) ha validado la solicitud de autorización de comercialización (MAA) que fue presentada por la farmacéutica Roche para el satralizumab, que sirve para tratar a los pacientes adultos y adolescentes con trastorno del espectro de neuromielitis óptica (Nmosd) , otorgándole la Evaluación Acelerada.
La Agencia Europea de Medicamentos abre la primera puerta a un nuevo medicamento para la neuromielitis óptica
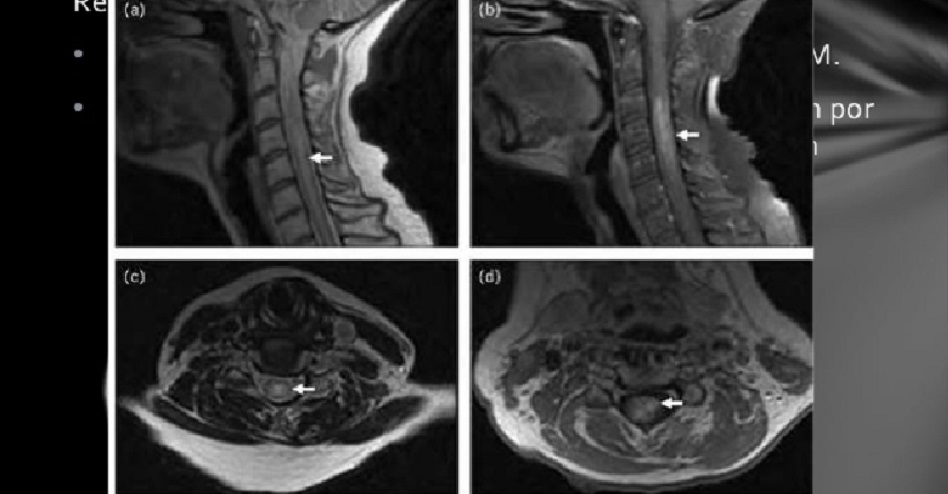
La neuromielitis óptica es un trastorno del sistema nervioso central que afecta principalmente los nervios del ojo (neuritis óptica) y la médula espinal (mielitis).
La validación confirma que la presentación está completa y significa que el MAA está bajo revisión por el Comité de Medicamentos de Uso Humano (CHMP) de la EMA. La Administración de Drogas y Alimentos de los Estados Unidos (FDA) también aceptó la solicitud de licencia de productos biológicos (BLA) de la compañía para satralizumab. La recomendación del CHMP y la decisión de la FDA se esperan para 2020, ha explicado Rche a través de un comunicado.
Las personas que viven con Nmosd experimentan recaídas impredecibles que pueden causar daño neurológico permanente
Las personas que viven con Nmosd experimentan recaídas impredecibles que pueden causar daño neurológico permanente, y aunque recientemente ha habido avances significativos en la comprensión de la enfermedad, se necesitan opciones más aprobadas con diferentes enfoques de tratamiento.
“Satralizumab ha demostrado una eficacia robusta sostenida durante 96 semanas y redujo significativamente el riesgo de recaída en una amplia población de pacientes, al tiempo que ofrece una dosis subcutánea autoadministrada cada cuatro semanas”, ha dicho Levi Garraway, director médico de Roche y jefe de desarrollo de producto global.
La evaluación acelerada reduce el plazo para que la EMA y el CHMP revisen la autorización de comercialización, lo que significa que el tratamiento es de gran interés para la salud pública o la innovación terapéutica.

Suscríbete a la newsletter de modaengafas.com
Noticias relacionadas